Como a cerveja contribuiu para revolucionar a química moderna?

Por Pietro Santiago, Químico, professor e palestrante. Técnico em cerveja e sommelier de cervejas pela Science of beer.
A cerveja contribuiu para revolucionar a ciência desde a pasteurização de alimentos ao desenvolvimento da bomba hidráulica, mas sua importância não para por aí. Ela foi protagonista na criação de um dos parâmetros físico-químicos mais importantes da Química moderna. Mas como uma bebida tão alegre e festiva poderia estar associada a uma ciência tão complexa?
A Química se fundamenta como a ciência que estuda os diferentes tipos de materiais, suas propriedades e seus constituintes. Estuda a matéria em toda sua extensão, das características mais íntimas até as características macroscópicas. Ela está disseminada em diversos setores de nossa sociedade atuando sempre no desenvolvimento e melhoria de produtos e de processos e na indústria cervejeira não poderia ficar de fora.
Foi no laboratório de controle de qualidade da cervejaria dinamarquesa Calrsberg que o Químico Søren Peter Lauritz Sørensen, em 1909, introduziu o conceito que viria revolucionar a Química. Sørensen realizou diversas experiências em bioquímica, relacionadas ao efeito de íons hidrogênio em aminoácidos, proteínas e enzimas, conduzindo-o à descoberta da medição do potencial hidrogeniônico, pH. Não demorou para que essa escala fosse aceita pela comunidade científica da época e em 1935 já havia medidor portátil de pH sendo desenvolvido e comercializado.
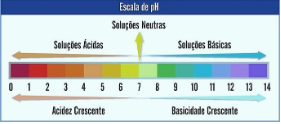
Disseminado em todos os setores da química, o pH passou a ser um dos principais parâmetros físico-químicos existentes. Esse parâmetro é uma escala numérica associada a acidez das soluções aquosas sendo medida pelo cologarítimo decimal da concentração hidrogeniônica.
pH = colog [H3O+] ou pH = - log [H3O+]
Em solução aquosa a 25ºC o pH pode assumir valores compreendidos entre 0 e 14. Valores inferiores a 7 indicam que a solução possui caráter ácido. Quanto menor o valor do pH, maior é a sua acidez. Valor de pH superior a 7 indica maior alcalinidade da solução e, portanto, menor acidez. Valor igual a 7 a solução tem caráter neutro.
O controle desse parâmetro é fundamental em diferentes etapas da produção de cerveja. Na mostura a ação enzimática está intimamente relacionado ao pH. Em geral nessa etapa o pH deve ficar em torno de 5,4 e uma mudança brusca no valor do pH pode desnaturar as enzimas e prejudicar o mosto.
Na fervura, quanto maior o pH, maior a taxa de isomerização do alfa-ácido, porém quanto menor mais balanceado e mais agradável é o sabor oriundo do lúpulo. No final da fervura o pH compreendido entre 5,1 a 5,3 auxilia na sedimentação coloidal, descarregando as partículas dispersas tornando o mosto mais limpo.
Durante toda a fermentação e maturação também ocorre variação do pH que vai conferindo mudanças organolépticas na cerveja melhorando aroma e sabor. Sendo assim o controle desse parâmetro em cada uma dessas etapas é de fundamental importância para qualidade do produto e essencial para repetibilidade do processo.
